北京時間2025年2月20日,西湖大學未來產業研究中心、生命科學學院、西湖實驗室盧培龍課題組,在Nature雜志在線發表題為De novo design of transmembrane fluorescence-activating proteins的科研報道——他們首次實現了跨膜熒光激活蛋白的從頭設計,這也是第一個通過人工設計得到的能夠非共價結合特定小分子的跨膜蛋白。博士生朱璟熠、梁明福、孫科為本文共同第一作者,研究員盧培龍為通訊作者。

論文鏈接:
https://www.nature.com/articles/s41586-025-08598-8
顧名思義,跨膜蛋白“跨”在細胞膜上,如果將細胞膜看作城墻的話,膜蛋白就是進出城市的城門,細胞內外的物質交換、信息傳遞,都要通過各種各樣的膜蛋白來完成。人類基因組編碼的所有蛋白質中,有超過四分之一是膜蛋白。
人體的五種感覺——視覺、聽覺、觸覺、味覺和嗅覺——都依賴于膜蛋白的關鍵作用。拿視覺來說,人視網膜視錐細胞中的視紫紅質(rhodopsin),是人類直接感受光信號的分子,它結合作為感光基團的視黃醛(retinal),并借助視黃醛分子光致變構的特性,對外界的光信號作出響應,從而使人類能夠看見多姿多彩的大千世界。
作為細胞生命活動的核心部件,膜蛋白的功能一旦出現異常,細胞乃至整個生命體的生理活動就容易出問題,各種疾病也便隨之而來。目前世界上大約一半現代藥物的靶標分子都屬于膜蛋白。在許多常見的心血管疾病、精神類疾病,以及更難治療的癌癥、阿爾茨海默癥等疾病中,都能夠找到與其密切相關的膜蛋白分子,增強或抑制這些膜蛋白的功能,很可能成為治療疾病的關鍵。
“那么是否有可能通過人工設計來按需定制全新的、理想的膜蛋白呢?”
10年前,盧培龍加入了華盛頓大學蛋白質設計研究所——也就是2024年諾貝爾化學獎獲得者David Baker的課題組——開啟了一段長達5年的博士后研究。2018年,也就是入組的第四年,他在世界上首次實現了對多次跨膜蛋白的精確從頭設計。該研究采用了多條螺旋狀的結構作為蛋白骨架,與天然存在的跨膜蛋白的常見架構相符合。
這項工作標志著對膜蛋白的精確設計的起步。也因為尚在起步階段,當時設計的膜蛋白只有結構,沒有生理功能。
2019年,盧培龍回國,全職加入西湖大學生命科學學院,組建了自己的課題組——蛋白質設計實驗室。2020年8月,Nature報道了由他與David Baker團隊合作完成的最新研究——全球首次實現對跨膜孔蛋白的精確從頭設計。
這次在Nature發表的新工作,是盧培龍在2019年回國后開展的,一作朱璟熠是2019級博士研究生。他入學的時候,實驗室才剛剛“開張”,他跟著盧老師從買試劑買設備開始,想盡快把這個課題啟動起來。
他們的目標,是從頭設計一種能夠特異性地結合某種小分子的跨膜蛋白。這好比在生物膜環境中創造了一個獨特的“泊位”,只能允許特定類型的“船舶靠岸”停放。
前面提到的人類直接感受光信號的視紫紅質,就是因為具有能夠特異結合視黃醛分子的“泊位”,才能夠發揮感光的作用。這里“特異結合”的結構,被形象地稱為“結合口袋(binding pocket)”。不同膜蛋白的“結合口袋”能夠根據其獨特的結構,來識別、結合與之相匹配的特定配體,從而實現特定的功能。比如葡萄糖轉運蛋白轉運葡萄糖分子進入人體細胞,為細胞提供能量;或者NMDA受體被氯胺酮藥物分子抑制,對抑郁癥起到治療的作用。
課題組計劃在從頭設計的蛋白內部也構建一個這樣的“口袋”,來特異性地結合目標配體分子。
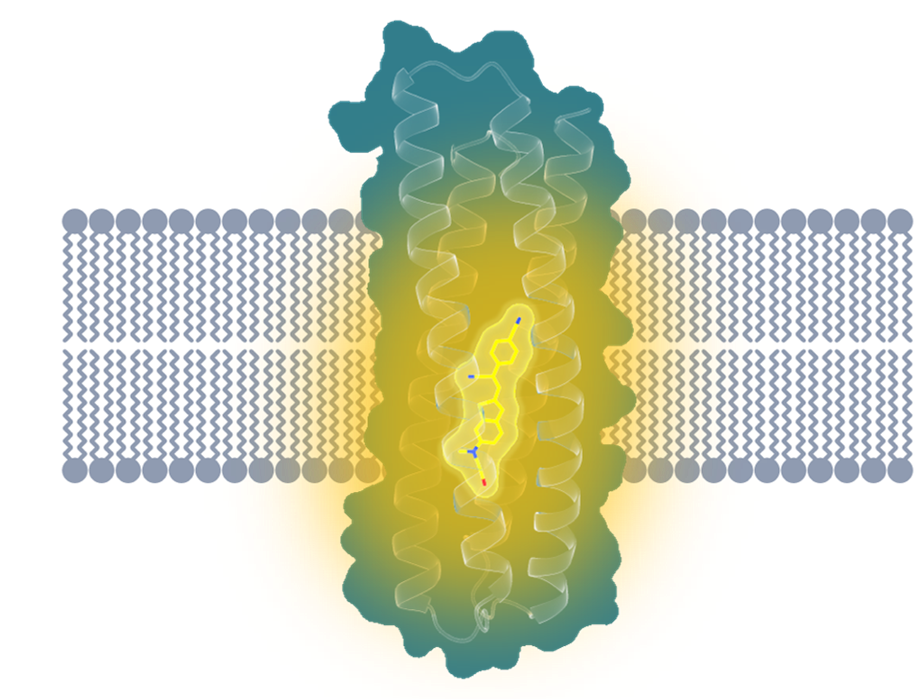
跨膜熒光激活蛋白結構示意圖
作為結合目標的小分子,他們也選好了——一種名叫HBC的熒光基團。這種分子在游離狀態下并不會發光,只有當以特定姿態被穩定結合,才能發出熒光。如果成功,這項技術有望廣泛應用在膜成像、跨膜傳感器、跨膜物質傳輸等領域。
選擇熒光基團作為目標配體分子還有另外一個理由。在上一次設計“跨膜孔蛋白”的時候,為了驗證那些離子究竟是不是從設計好的通道蛋白中透過去的,需要用復雜的測試體系才能得到強有力的證據,這一過程花費了課題組大量的時間。而如果選擇會發光的分子,亮了即代表成功,一目了然。
設計過程分為兩步——先設計一個水溶性、不跨膜的簡易版;成功后,再將其改造成跨膜蛋白。
研究人員打磨了數不清的設計版本,終于成功構建出了這樣一個“口袋”,它不僅成功地結合(點亮)了配體熒光基團HBC599,而且結合后的熒光強度是游離狀態的上千倍,遠超天然跨膜熒光蛋白。
再后來,研究人員們一方面穩住好不容易得來的“口袋”結構,另一方面把蛋白表面從“親水”設計成“疏水”,最終得到了一個“跨膜”版本的熒光激活蛋白。這一次足足亮了1600倍!
2023年9月,盧培龍最后一輪修改完文章,正式向Nature投稿。龍年春節前夕,編輯發回三位匿名審稿人的意見,評價兩極化非常嚴重。對設計的跨膜熒光蛋白進行實驗結構解析,為這個課題保留了一線生機,但也僅僅只有“一線”而已。冷靜下來后,盧培龍也認可這個審稿意見。“此前確實有很多人嘗試設計膜蛋白,也不乏一些有意思的結果,但最大的問題在于它們很難形成穩定的三維結構,缺乏結構上的驗證,又或者很難做到實驗中獲得的結構與設計模型一致。”
“不管是結構生物學,還是蛋白質設計,我都是在全世界最強的實驗室里學的。”盧培龍在這樣的打氣中覓得了解題思路,“我們的跨膜熒光蛋白太小了,可以用蛋白質設計的方法把它變大呀!”
2024年9月,距離上一次投稿正好一年。課題組成功解析出設計蛋白與熒光基團復合物的高分辨率冷凍電鏡結構,證實其與設計模型高度一致。修改完善后的文章,終于得到了三位審稿人的正面意見。
① 凡本站注明“稿件來源:中國教育在線”的所有文字、圖片和音視頻稿件,版權均屬本網所有,任何媒體、網站或個人未經本網協議授權不得轉載、鏈接、轉貼或以其他方式復制發表。已經本站協議授權的媒體、網站,在下載使用時必須注明“稿件來源:中國教育在線”,違者本站將依法追究責任。
② 本站注明稿件來源為其他媒體的文/圖等稿件均為轉載稿,本站轉載出于非商業性的教育和科研之目的,并不意味著贊同其觀點或證實其內容的真實性。如轉載稿涉及版權等問題,請作者在兩周內速來電或來函聯系。





 中國教育在線
中國教育在線




